Din cuprinsul articolului
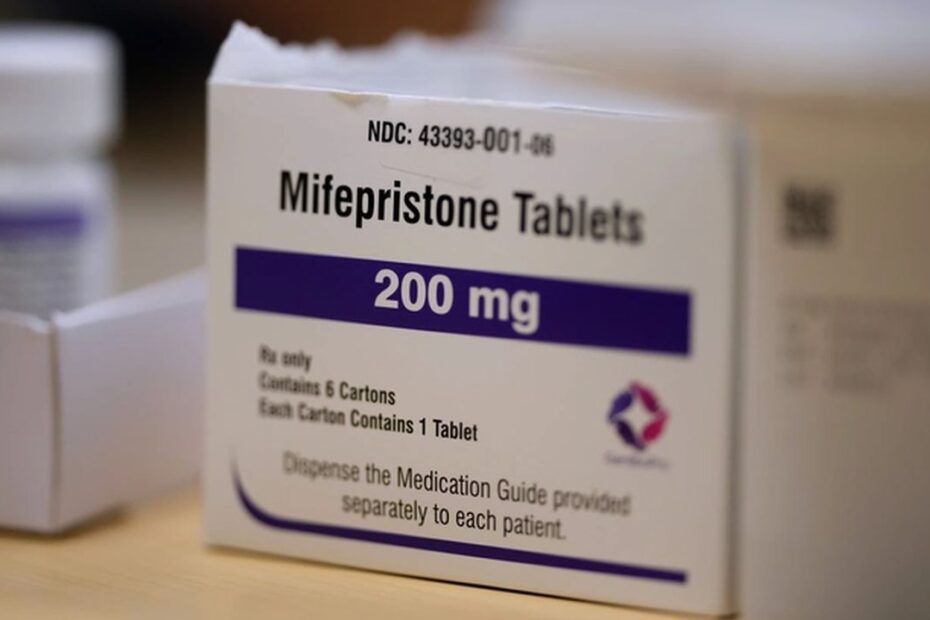
Decizia FDA de a aproba produsul companiei Evita Solutions a generat luări de poziții contradictorii. Pe 2 octombrie 2025, Food and Drug Administration (FDA) a a anunțat că a aprobat un nou medicament generic bazat pe mifepristonă, produs de compania Evita Solutions (reuters.com). Aprobarea a fost emisă printr-o cerere de tip ANDA (Abbreviated New Drug Application) depusă în 2021, iar FDA a confirmat că versiunea produsă este bioechivalentă și terapeutic echivalentă cu Mifeprex (mifepristonă 200 mg), comercializat de Danco Laboratories (contemporaryobgyn.net).
Astfel, Evita Solutions are acum dreptul de a comercializa o versiune generică de mifepristonă, un medicament esențial în procedura de întrerupere medicală a sarcinii, în regim combinat cu misoprostol. Aprobarea, emisă la 2 octombrie 2025, a fost primită atât cu sprijin din partea comunității medicale, cât și cu critică vehementă din partea grupărilor și liderilor politici anti-avort. Deși FDA a insistat că procedura de aprobare a fost una standard, controversa politică reflectă tensiunile actuale din jurul reglementării accesului la avort prin medicamente.
Decizia FDA de a aproba produsul pe baza de mifepristonă este luată ținând cont de decenii de studii științifice
Mifepristona este folosită împreună cu misoprostol pentru întreruperea medicală a sarcinii până în săptămâna a 10‑a (aproximativ 70 de zile de la ultima menstruație) (apnews.com).
Aprobarea include integrarea produsului în programul REMS (Risk Evaluation and Mitigation Strategy), care impune măsuri de siguranță stricte pentru utilizarea medicamentului (contemporaryobgyn.net).
FDA și comunitatea medicală (inclusiv organizații precum American Medical Association) continuă să susțină siguranța și eficacitatea mifepristonei, bazându-se pe decenii de studii științifice (theguardian.com). În plus, aprobarea unui alt generic ar putea reduce costurile și extinde accesul la acest tratament, în special în zonele rurale sau în statele cu restricții stricte privind accesul .
Reacții politice și ale organizațiilor anti-avort
Decizia a stârnit reacții puternice din partea grupurilor și politicienilor anti-avort. De exemplu, organizația Students for Life Action a numit aprobarea „o pată asupra președinției Trump” (apnews.com). Senatorul Josh Hawley a declarat că și-a pierdut încrederea în conducerea FDA
Criticii au subliniat că aprobarea contravine promisiunilor recente ale Secretarului pentru Sănătate, Robert F. Kennedy Jr., și ale Comisarului FDA, Marty Makary, de a revizui siguranța mifepristonei (axios.com). Totuși, FDA a precizat că are o discreție limitată în aprobarea medicamentelor generice, atâta timp cât acestea sunt echivalente chimic cu originalul (axios.com).
Decizia FDA de a aproba produsul este atacată în justiție. Există litigii federale în curs
Există numeroase cazuri legale care contestă reglementările FDA privind mifepristona:
- Alliance for Hippocratic Medicine v. FDA: un caz semnificativ în care grupuri anti-avort au cerut anularea aprobării medicamentului. Curtea Supremă a SUA a respins cazul în iunie 2024, invocând lipsa de interes juridic (standing) al reclamanților (reuters.com).
- Un alt proces, inițiat în 2022, a fost transferat din Texas în Missouri în octombrie 2025, pentru continuarea analizelor privind reglementări mai permisive ale FDA, inclusiv telemedicina și distribuția prin poștă (reuters.com).
- State precum Texas și Florida au solicitat să se alăture procesului pentru a contesta direct politicile FDA, în efortul de a limita accesul la mifepristonă informează și washingtonpost.com.
Decizia FDA este aplicată diferit de statele americane prin decizii locale
Aproximativ jumătate dintre state continuă să impună restricții drastice asupra avortului, inclusiv asupra avortului medicamentos, în ciuda deciziei FDA de relaxare a cerințele de utilizare în cadrul programului REMS prin eliminarea obligativității prezenței fizice și permițând farmaciilor certificate să distribuie mifepristona (americanprogress.org). Restricții suplimentare impuse de aceste state, precum cerințe de examinare în persoană sau interdicții privind telemedicina, care intră în conflict cu reglementările federale, au generat litigii în instanțele statale deoarece producătorii riscă sancțiuni dacă livrează medicamentul conform regulilor FDA, dar în contradicție cu legile statale. În aceste state, accesul rămâne limitat, chiar dacă FDA permite telemedicina și livrarea prin poștă .
Cu toate acestea, în statele permisive, modificările REMS (telemedicină, farmacii certificate) au extins accesul în mod semnificativ la acest produs. Totodată, chiar în state unde mifepristona este legală, numeroase farmacii — chiar și lanțuri majore — aleg să nu o distribuie, din motive ideologice sau legale, limitând astfel accesul.
În plus, pacienții din state restricționate călătoresc între state pentru a obține medicamentul, ceea ce implică costuri și dificultăți logistice considerabile.
Decizia FDA de a aproba produsul companiei Evita Solutions între acces și limitări
- Aprobarea generică de către FDA a Evita Solutions din 2 octombrie 2025 este o decizie tehnică menită să extindă accesul și să reducă costurile în privința avortului, dar a generat reacții politice și acuzații de subminare a politicilor anti-avort .
- În plan juridic, decizia se încadrează într-un context complex de litigii federale și statale, incluzând transferuri de cazuri, încercări de preemțiune și provocări privind telemedicina și distribuția prin poștă
- În privința accesului, beneficiile reale — în special pentru pacienți din state permisive — includ telemedicina și distribuția farmaceutică extinsă. Totuși, statele restrictive continuă să limiteze aceste opțiuni, iar distribuția rămâne inconsistentă