Din cuprinsul articolului
Agenția Europeană pentru Medicamente recomandă retragerea de pe piața Uniunii Europene a medicamentelor care conțin levamisol, după ce o reevaluare a confirmat apariția unei reacții adverse rare, dar severe: leucoencefalopatia. Decizia vizează inclusiv produse autorizate în România și schimbă modul în care sunt tratate anumite parazitoze.
Levamisolul, retras după confirmarea unui risc neurologic grav
Comitetul pentru evaluarea riscurilor în materie de farmacovigilență al EMA, PRAC, a concluzionat că beneficiile levamisolului nu mai depășesc riscurile în tratamentul parazitozelor la adulți și copii.
Potrivit comunicatului oficial transmis de Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România, „leucoencefalopatia a fost confirmată ca reacție adversă rară, însă gravă, a levamisolului”
Leucoencefalopatia afectează materia albă a creierului, formată din fibre nervoase acoperite de mielină. Distrugerea acestei structuri poate compromite comunicarea dintre zonele creierului și poate deveni o afecțiune debilitantă sau chiar letală.
Simptomele pot apărea după o singură doză
Evaluarea realizată la nivel european arată că simptomele pot apărea chiar după administrarea unei singure doze de levamisol și se pot dezvolta în decurs de câteva luni de la tratament
Manifestările neurologice pot include:
- slăbiciune musculară
- tulburări de limbaj
- confuzie
- probleme de coordonare
- afectare cognitivă
- pareză
Specialiștii au subliniat că nu a fost identificat niciun grup de pacienți cu risc mai mare și nicio măsură eficientă de reducere a riscului. Acest caracter imprevizibil a cântărit decisiv în recomandarea de retragere.
Pentru ce era folosit levamisolul
Levamisolul este un medicament antihelmintic utilizat pentru tratarea infecțiilor cu paraziți precum:
- Ascaris lumbricoides
- Necator americanus
- Ancylostoma duodenale
- Strongyloides stercoralis
- Trichostrongylus colubriformis
Substanța acționează prin stimularea receptorilor nicotinici ai viermilor intestinali, provocând paralizia acestora și eliminarea prin tranzitul intestinal.
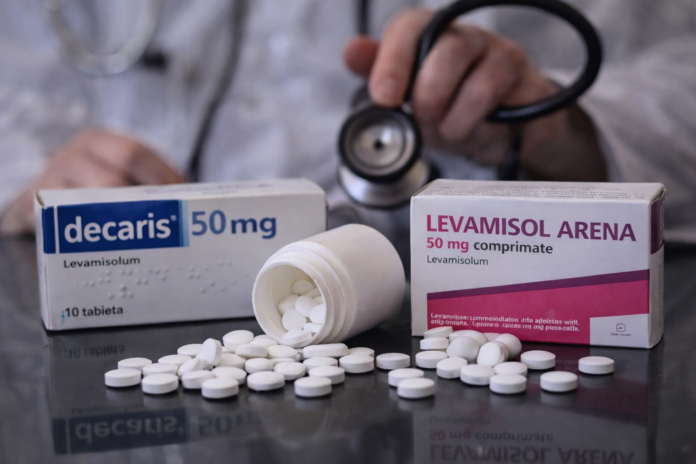
În România și în alte state membre, medicamentele erau disponibile sub formă de comprimate administrate, de regulă, în doză unică. În țara noastră, acestea sunt autorizate sub denumirile comerciale Decaris și Levamisol Arena
Ce trebuie să știe pacienții
EMA precizează că există alternative terapeutice autorizate în Uniunea Europeană pentru tratamentul parazitozelor
Pacienții care au utilizat levamisol trebuie să solicite imediat consult medical dacă apar simptome neurologice precum:
- slăbiciune bruscă
- dificultăți de vorbire
- tulburări de coordonare
- confuzie
Autoritățile europene transmit că monitorizarea siguranței medicamentelor continuă permanent, iar atunci când datele arată că riscurile pot depăși beneficiile, se intervine pentru protejarea sănătății publice
Următorii pași în procedură
Reevaluarea a fost inițiată la solicitarea ANMDMR, conform articolului 31 din Directiva 2001/83/CE. Recomandarea PRAC va fi transmisă Grupului de Coordonare pentru Procedurile de Recunoaștere Reciprocă și Descentralizate – Uman, care va adopta o poziție finală la nivelul statelor membre
O comunicare directă către profesioniștii din domeniul sănătății va fi publicată pe site-ul ANMDMR.
Decizia marchează una dintre cele mai importante intervenții recente în domeniul farmacovigilenței la nivel european și reflectă standardele stricte de siguranță impuse pentru medicamentele disponibile în Uniunea Europeană.